2月17日,诺华宣布欧盟委员会已批准Beovu(brolucizumab)注射液用于治疗湿性年龄相关性黄斑变性(wet-AMD)。Beovu是欧盟批准的首个与Eylea(阿柏西普)相比在减少视网膜液(疾病活动的关键标志物)方面表现更优的抗VEGF药物。Beovu在符合资格的湿性AMD患者中还提供了在加载期(loading phase)后立即给予3个月给药间隔维持治疗的能力。在美国,Beovu于2019年10月获得FDA批准。
湿性AMD是一种慢性退行性眼病,由过量的VEGF引起。VEGF是一种促进黄斑下异常血管生长的蛋白质,黄斑是视网膜上形成清晰中心视觉的区域。湿性AMD是65岁以上人群严重视力丧失和失明的主要原因,影响到全世界2000多万人。在欧盟,估计有170万人受到湿性AMD的影响。湿性AMD的早期症状包括视力模糊或波动。随着病情的发展,患者会失去中心视力,很难直接看到其面前的物体。
此次批准,基于III期HAWK和HARRIER临床试验的数据。在这两项研究中,Beovu达到了主要终点:在治疗第一年(第48周),最佳矫正视力(BCVA)增加非劣效于Eylea。第一年的视力增加在第二年能够维持。
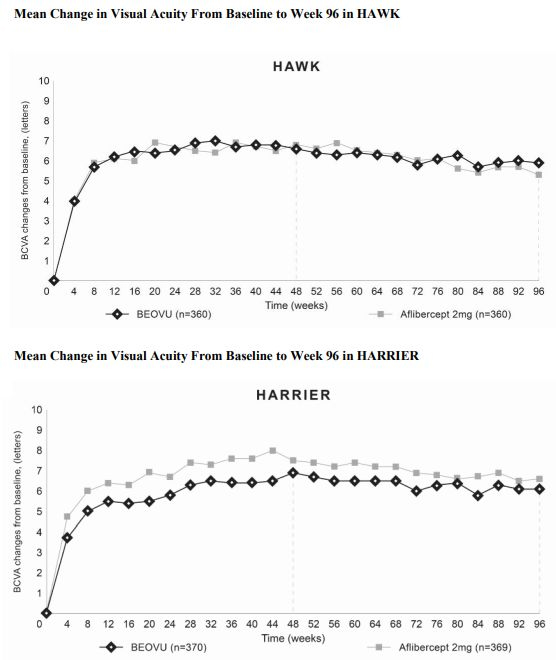
与视网膜液相关的次要终点方面,Beovu表现优于Eylea:有视网膜内液和/或视网膜下液的患者比例显著较少,这两种液体可能会破坏正常的视网膜结构并对黄斑造成损害(治疗第一年,HAWK:Beovu 6mg组为31%、Eylea组为45%;HARRIER:Beovu 6mg组为26%,Eylea组为44%。)。此外,Beovu在治疗第16周和第一年时降低中央亚区厚度(视网膜液的另一个指标)方面显著优于Eylea。第一年观察到的差异在第二年能够维持。两项研究中,早在第16周,Beovu与Eylea相比,有疾病活动迹象的患者减少30%。
两项研究中,在第一年,Beovu 6mg组有超过一半的患者维持三个月给药间隔(HAWK:56%;HARRIER:51%)、其余患者在两个月给药间隔下维持治疗。第二年时,仍有很高比例的患者维持3个月给药间隔(HAWK:45%;HARRIER:39%)。两项研究中,维持3个月给药间隔的概率,第一年(第20周-第48周)分别为85%和82%、第二年(第48周-第96周)分别为82%、75%。
Beovu的活性药物成分为brolucizumab,这是一种人源化单链抗体片段(scfv)。单链抗体片段因其体积小、组织渗透性增强、系统循环中的快速清除、药物递送特性而在药物开发中备受追捧。
Brolucizumab的创新结构使其仅有26kDa大小,针对VEGF-A所有亚型具有强大的抑制作用和高亲和力。Beovu旨在提供最高浓度的药物,比其他抗VEGF药物提供更多的活性结合剂。在临床前研究中,brolucizumab通过阻断配体-受体相互作用抑制VEGF受体的激活。增强的VEGF途径信号转导与病理性眼部血管生成和视网膜水肿相关。抑制VEGF途径已被证明能抑制新生血管病变的生长,抑制内皮细胞增殖和血管通透性。
参考来源:Novartis receives EC Approval for Beovu, a next-generation anti-VEGFtreatment for wet AMD, a leading cause of blindness worldwide
来源:医药第一时间 作者: sinayiyao
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..