今日,Epizyme公司宣布,美国FDA已接受其开发的“first-in-class“EZH2抑制剂 Tazverik(tazemetostat)的补充新药申请(sNDA),用于治疗复发或难治性滤泡性淋巴瘤(FL)患者。 这些患者至少接受过两种前期系统性治疗。FDA同时授予该申请优先审评资格,预计将于今年6月18日前做出回复。今年1月,FDA已批准Tazverik治疗转移性/局部晚期上皮样肉瘤患者。

FL是非霍奇金淋巴瘤的一种。大约20%的FL患者的 EZH2 基因携带功能获得性基因突变,导致EZH2的活性升高。 而这会导致B细胞被“锁死”在生发状态(germinal state),从而促使它们癌变。
Tazverik是一款“first-in-class”组蛋白赖氨酸甲基转移酶(Histone-Lysine N-methyltransferase)EZH2抑制剂。Tazverik通过抑制EZH2的活性,能够让B细胞继续分化或者产生细胞凋亡,从而控制肿瘤的生长。
这一申请是基于Tazverik在一项2期临床试验中的中期结果。在这项单臂试验中,携带野生型 EZH2 基因或突变型 EZH2 基因的FL患者接受了Tazverik的单药治疗。 试验结果表明,Tazverik的治疗使 携带 EZH2 突变的患者达到 69%的客观缓解率(ORR),在野生型EZH2患者亚组中的这一数值为35%。 突变型EZH2患者的中位无进展生存期(PFS)为14个月,野生型EZH2患者的PFS为11个月。这两个患者亚组的中位OS均尚未达到。
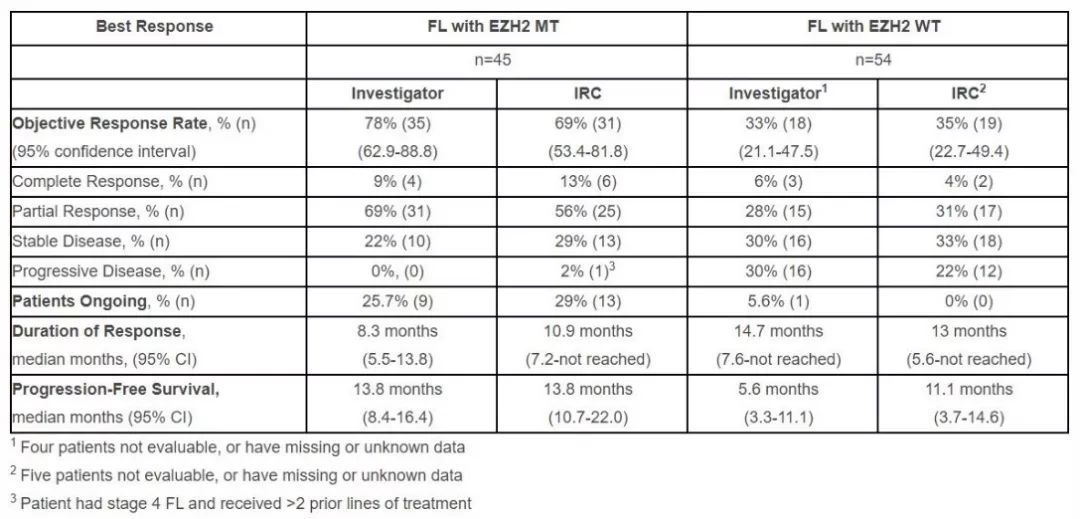
▲Tazemetostat的中期试验结果(图片来源:参考资料[3])
“滤泡性淋巴瘤是一种无法治愈的疾病,因此患者需要一种安全,持久的治疗方案,”Epizyme公司首席医学官Shefali Agarwal博士说:“如果获得批准,我们相信Tazverik可能成为这些患者的重要治疗选择。我们非常高兴FDA可以授予Tazverik优先审评资格,并感谢患者,护理人员和研究人员做出的贡献。”
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..