ImmunoGen是一家临床阶段的生物技术公司,专注于开发新一代抗体药物偶联物(ADC)以改善癌症患者的预后。近日,该公司宣布,美国食品和药物管理局(FDA)已建议:在铂耐药卵巢癌中开展一项新的单臂研究,可以支持对mirvetuximab soravtansine(IMGN853)的加速批准。
基于这一指导,该公司将启动SORAYA研究,这是一项关键性试验,将评估mirvetuximab soravtansine作为单药疗法在先前接受过Avastin(bevacizumab,贝伐单抗)治疗、叶酸受体α(FRα)高表达、铂耐药卵巢癌患者中的疗效和安全性。
ImmunoGen总裁兼首席执行官Mark Enyedy表示:“我们已经与FDA进行了建设性的讨论,并评估了将mirvetuximab soravtansine更快地应用于患者的所有途径。我们已与
FDA达成一致意见,先前接受过贝伐单抗治疗但疾病进展的FRα高表达铂耐药卵巢癌患者需要更好的治疗方案。我们很高兴启动SORAYA研究,在这一患者群体中评估mirvetuximab soravtansine,如果成功,将使我们能够在2021年下半年提交加速审批申请。我们预计,SORAY研究将在下一季度入组首例患者,并预计2021年年中获得顶线数据。”
该公司mirvetuximab soravtansine项目现在包括2个新的试验SORAYA和MIRASOL:(1)SORAYA是一项关键性单臂试验,将入组约100例患者,合格标准包括采用PS2+评分法确认为表达高水平FRα、先前已接受过至多3种方案且至少一种含有贝伐单抗、铂耐药卵巢癌患者。主要终点是研究调查员评估的总缓解率(ORR),关键次要终点是缓解持续时间(DOR)。(2)MIRASOL是一项确认性随机III期试验,430例患者将以1:1的比例随机接受mirvetuximab soravtansine或调查员选择的单剂化疗(每周一次紫杉醇、聚乙二醇化脂质体阿霉素、拓扑替康)。合格标准包括采用PS2+评分法确认为表达高水平FRα、先前已接受过至多3种方案且、铂耐药卵巢癌患者。主要终点是研究调查员评估的无进展生存期(PFS),关键次要终点包括总缓解率(ORR)、总生存期(OS)、患者报告结果。
mirvetuximab soravtansine(IMGN853)是首个叶酸受体α(FRα)靶向ADC,使用一种人源化的FRα结合抗体将ADC专门靶向表达FRα的癌细胞,并使用一种强效抗
肿瘤剂DM4杀死所靶向的癌细胞。
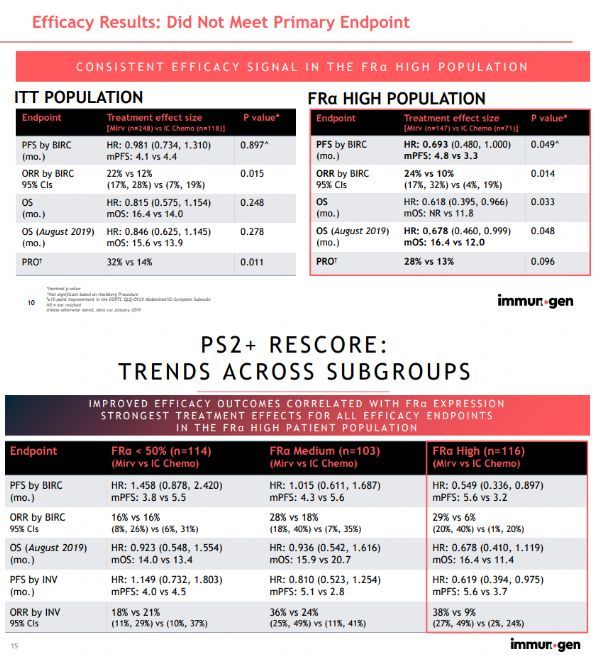
今年3月,ImmunoGen公司公布了mirvetuximab soravtansine治疗FRα阳性、铂耐药卵巢癌III期FORWARD-I研究的结果。显示,研究未能达到主要终点:在整个研究群体中,与化疗相比,mirvetuximab soravtansine未能显著延长PFS。然而,在预先指定的FRα高表达亚组患者中,mirvetuximab soravtansine表现出了令人印象深刻的疗效和耐受性,包括PFS延长(HR=0.69,p=0.049)、ORR提高(24% vs 10%,p=0.014)、OS延长(HR=0.62,p=0.033)。该研究中,mirvetuximab soravtansine的耐受性良好,发生3级或以上不良事件的患者更少(46% vs 61%)、更少的剂量减少(20% vs 31%),因药物相关不良事件导致的停药率更低(5% vs 8%)。
该公司已采用PS2+评分法审查了I期和FORWARD I研究中产生的数据,并确定了70例符合SARAYA关键资格标准的患者。数据显示,在这些患者中的ORR为31.4%(95%CI:20.9%,43.6%)、DOR为7.8个月(95%CI:3.98,-)。这些数据与单用化疗治疗铂耐药卵巢癌的ORR相比相当好,在AURELIA和CORAIL试验中单用化疗的ORR仅为12%,其中包括贝伐单抗初治和经治的患者。
在SORAYA研究中重复出这些数据,将支持在MIRASOL研究完成之前申请加速审批。之后,MIRASOL研究将提供由加速批准转为完全批准所需的随机数据。(生物谷Bioon.com)
原文出处:
1、ImmunoGen Announces Accelerated
approval Pathway for Mirvetuximab Soravtansine in Ovarian Cancer