今日,罗氏(Roche)旗下基因泰克(Genentech)宣布,美国FDA已接受其IL-6抗体satralizumab的生物制剂许可申请(BLA),用于治疗视神经脊髓炎谱系障碍(NMOSD)的成人和青少年患者。同时,欧洲药品管理局(EMA)也接受了satralizumab的营销授权申请(MAA),并授予其加速评估资格(Accelerated Assessment)。预计FDA和EMA人用药品委员会(CHMP)将在2020年对这一申请做出批复。
NMOSD是一种罕见的失能性中枢神经系统(CNS)自身免疫性疾病,在全球范围内影响着多达数十万人。患者主要症状为视神经和脊髓出现炎症性病变。NMOSD患者经常会出现疾病复发,免疫系统对自身组织的反复攻击会导致神经损伤逐步积累和残疾。患者会出现视力、运动功能和生活质量的下降,严重NMOSD发作可以导致死亡。目前,还没有治疗这种疾病的获批疗法。
虽然NMOSD被认为是由于靶向AQP4的自身免疫抗体进入CNS导致的疾病,但是大约三分之一的患者体内没有靶向AQP4的自身免疫抗体。近年来,促炎症细胞因子IL-6是NMOSD病理发生中的一个新兴重要靶点,它触发炎症级联反应,导致损伤和残疾。罗氏开发的satralizumab是一种完全人源化的IL-6单克隆抗体。它可以抑制IL-6信号通路,并且抑制炎症的产生和靶向AQP4的自身免疫抗体生成。Satralizumab每四周皮下注射一次,对患者和护理人员来说是一个方便的治疗选择。去年12月,美国FDA授予该疗法突破性疗法认定。
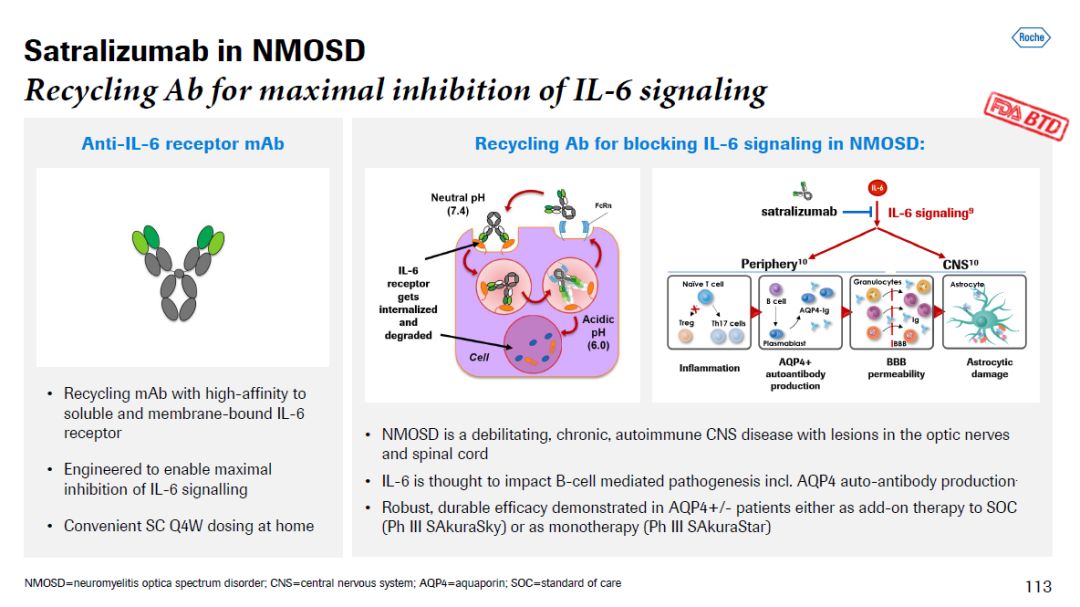
▲Satralizumab简介(图片来源:参考资料[2])
该申请是基于名为SakuraStar和SAkuraSky的两项关键性3期临床研究的积极结果。这两项试验分别评估了satralizumab作为单一疗法,和与标准疗法联合治疗NMOSD患者的疗效和安全性。SakuraStar的研究结果显示,与安慰剂组相比,接受satralizumab单药治疗的患者,复发风险降低55%。96周和48周的无复发比例分别为76.1%和72.1%,而在安慰剂组患者的这一比例分别为61.9%和51.2%。此外,在携带AQP4自身抗体的患者亚组中,接受satralizumab单药治疗的患者复发风险可降低74%。96周和48周的无复发比例分别为76.5%和82.9%,而在安慰剂组患者中的这一数字分别为41.1%和55.4%。
SAkuraSky的研究结果显示,与安慰剂组相比,接受satralizumab与标准疗法联合治疗的患者复发风险可降低62%。96周和48周的无复发比例分别为77.6%和88.9%,而在安慰剂组患者的这一比例分别为58.7%和66%。在携带AQP4自身抗体的亚组中,接受satralizumab与标准疗法联合治疗的患者复发风险可降低79%。96周和48周的无复发比例为91.5%,而在安慰剂组中的这一数字分别为53.3%和59.9%。
“NMOSD患者经常会出现疾病复发,并可能导致永久性的神经损害。Satralizumab已经在试验中显示出可持续96周的疗效,并在广泛的患者群体中显著降低了复发风险,”罗氏全球产品开发部负责人,兼首席医学官Levi Garraway 博士说:“FDA和EMA接受satralizumab的上市申请是我们向NMOSD患者提供新药的道路上迈出的重要一步。我们期待与监管机构合作,尽快将satralizumab带给NMOSD患者。”
[1] FDA Accepts Genentech’s Biologics License Application for Satralizumab for Neuromyelitis Optica Spectrum Disorder, Retrieved October 30, 2019, from https://www.businesswire.com/news/home/20191029006190/en/
[2] Roche Pharma Day 2019. Retrieved September 16, 2019, from https://www.roche.com/dam/jcr:8f38992b-8977-46d3-8d92-f4f3f939245a/en/irp20190916.pdf
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..