先声药业(Simcere)合作伙伴Merus近日在波士顿举行的AACR-NCI-EORTC分子靶点和癌症治疗国际会议上公布了通过早期获取项目(EAP)接受双特异性抗体候选药物MCLA-128治疗的NRG1融合癌症患者的初步临床数据。
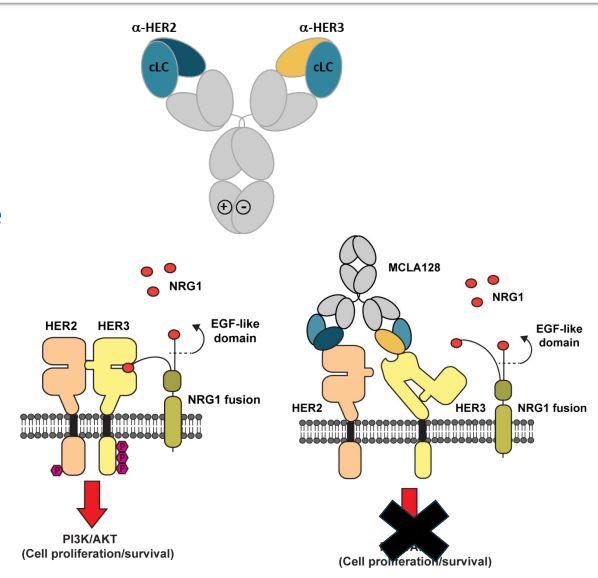
MCLA-128是一种靶向HER3信号通路的抗体依赖细胞介导细胞毒(ADCC)增强的BiLoopic®。这是一款双特异性抗体,与肿瘤细胞上大量表达的HER2结合,并通过与HER3结合有效地阻断heregulin(人表皮生长因子受体调节蛋白,HRG)刺激的肿瘤细胞生长。MCLA-128通过两种机制克服肿瘤细胞对HER2靶向治疗的固有和获得性抵抗:1)阻断生长和存活途径以阻止肿瘤扩增;2)招募和增强免疫效应细胞以消除
肿瘤。
NRG1基因编码neuregulin(又名heregulin),即HER3的配体。NRG1和伴侣基因融合是罕见的致癌基因事件,发生在某些肺癌和其他癌症患者中,与HER2/HER3异二聚体的激活和癌细胞的生长有关。在临床前研究中,Merus公司观察到MCLA-128能够有效抑制HER2/HER3异质二聚体的形成,从而阻断NRG1融合模型中
肿瘤细胞的生长。
MCLA-128作用机制
此次会议上,来自纪念斯隆-凯特琳癌症中心(MSKCC)的研究人员提供了一份总结和初步数据,涉及3例接受每两周一次静脉注射750mg MCLA-128治疗的NRG1融合癌症患者。这些患者的NRG1基因融合通过基于RNA的测序确定。该EAP项目的评估在MSKCC进行。这3例患者都显示出
肿瘤缩小、症状改善和持久缓解。目前,这3例患者仍在接受治疗。
胰腺导管腺癌(PDAC)EAP患者1:8周时的影像显示肿瘤直径缩小44%,在随后的5个月确认性扫描(RECIST v1.1评估为部分缓解[PR])中进一步改善为缩小54%。正电子发射断层扫描(PET)显示没有代谢活跃
肿瘤的迹象,相关的血清生物标记物(CA 19-9)显示在最初4周内表现改善。而且,在第一次给药后的几周内,患者的症状,包括疲劳和体重减轻,都有所改善。经过7个多月的治疗,患者仍在接受治疗。
PDAC EAP患者2:7周时的影像显示肿瘤直径缩小22%,5个月后的确认性扫描显示肿瘤直径缩小25%(RECIST v1.1评估为稳定疾病[SD]);PET影像显示没有代谢活跃肿瘤的迹象。患者因
肿瘤引起的腹痛在治疗后得到改善。经过7个多月的治疗,患者仍在接受治疗。
非小细胞肺癌(NSCLC)EAP患者3:8周时的影像学检查显示
肿瘤直径缩小33%,在随后的5个月确认性扫描(RECIST v1.1评估为PR)中进一步改善为缩小41%,脑转移也有所改善。在MCLA-128治疗之前,患者进行了六种疗法,包括酪氨酸激酶抑制剂阿法替尼(afatinib)。在大约5个月的治疗后,患者仍在接受治疗。
MSKCC早期药物开发服务部医学
肿瘤学家、三例患者的研究者Alison Schram表示:“这些最初的数据是一个重要的概念证明,证实了用MCLA-128靶向NRG1融合的前景。值得注意的是,其中两例患者患有胰腺癌,这是一种预后很差、治疗选择有限的疾病。MCLA-128的作用机制通过与HER2结合并阻断NRG1融合癌蛋白与HER3的相互作用,解决了具有NRG1融合的癌症的特异性分子异常,可能使MCLA-128特别适合于靶向这种独特的致癌驱动因素。”
MCLA-128在1/2期
临床试验中仍具有良好的耐受性,这与以前的报道一致。截至2019年1月,117例接受单药MCLA-128治疗的患者,每周至每三周一次的给药方案,报告的不良事件大多为轻度至中度(AE)。3级和4级不良事件的发生率分别为37%和3%,疑似药物相关3级不良事件的发生率约为4%,无疑似药物相关4级事件。一名患者出现5级过敏反应。到目前为止,MCLA-128在NRG1融合癌症患者中的安全性结果与先前在MCLA-128治疗的所有患者中的报道一致。
Merus是一家临床阶段的免疫
肿瘤公司,拥有开发创新全长人双特异性抗体的治疗药物技术平台Biclonics®。Biclonics®,基于全长免疫球蛋白IgG,使用行业标准方法生产制备双抗,并且在临床前研究中发现该平台制备的双抗与常规单克隆抗体有相似的特征,例如长半衰期和低免疫原性。
2018年1月,先声药业与Merus达成战略合作,获得Merus独家授权在中国区域利用Merus专有的 Biclonics®技术平台开发和商业化三种双特异性抗体。根据协议条款,Merus主导研究和发现,先声负责合作产品在中国的IND申报研究、临床开发、注册申报以及商业化。作为此项合作的关键战略要素,先声将在中国完成IND申报研究和临床样品生产,其将被用于支持Merus在全球其它区域的注册申报和早期临床开发。根据协议,Merus将获得首付、里程碑付款和中国区域的销售提成;先声也有权获得中国境外的销售提成。额外的财务细节未披露。
目前Merus进展最快的双特异性抗体候选药物是MCLA-128,治疗转移性
乳腺癌处于II期临床,治疗NRG1实体瘤处于I/II期临床。Merus进展第二快的双特异性抗体候选药物是MCLA-117,正在急性髓性
白血病患者中开展I期临床。Merus也拥有一系列双特异性抗体候选药物,包括:MCLA-158,处于I期临床,可与
癌症干细胞结合,潜在用于治疗结直肠癌和其它实体瘤;MCLA-145,处于I期临床,可与PD-L1和另一未公开的免疫调节靶点结合。(生物谷Bioon.com)