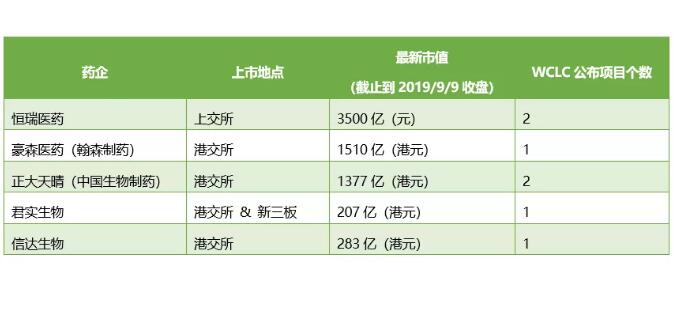
2019年国际肺癌研究协会(IASLC)主办的世界肺癌大会(WCLC 2019)正在(9月7-10日)西班牙巴塞罗那如火如荼地举行。与ASCO、AACR、CSCO等综合性癌症大会有所不同,WCLC更聚焦在肺癌和其它胸部恶性肿瘤。
之所以能自成门派,这也与肺癌是全球高发性癌症有关,占据肿瘤死因的第一位,且有持续增高趋势。业内甚至有句话叫做“得肺癌患者,得天下”。随着中国创新药企业的发展,也有不少企业在布局肺癌领域,其中今年就有5家企业的项目在WCLC 2019上以书面/口头汇报的形式展示。
1. 豪森制药
产品:HS-10296(奥美替尼 )
最高状态:NDA
患者标准: 既往EGFR-TKI耐药后T790M阳性的晚期NSCLC患者
入组人数:244例
疗效可评估人数: 244例
客观缓解率(ORR):68.4%
疾病控制率(DCR):93.4%
中位缓解持续时间(DoR):未达到
中位无疾病进展期(PFS):未达到
中位生存期(OS): 未达到
2019年4月17日,据国家药品监督管理局药品审评中心官网显示,江苏豪森申报上市的1 类新药甲磺酸奥美替尼(研发代号HS-10296)获CDE承办并公示。HS-10296是第三代、不可逆的EGFR-TKI表皮生长因子受体小分子抑制剂。
WCLC 2019第二天(9/8)披露了II期、开放多中心单臂研究,旨在确定奥美替尼在EGFR T790M突变的成人非小细胞肺癌(NSCLC)患者中的有效性和安全性。
该研究共纳入了244例既往EGFR-TKI耐药后T790M阳性的晚期NSCLC患者,接受奥美替尼110mg/天治疗。结果显示,主要终点指标ORR(客观有效率)达到68.4%,DCR(疾病控制率)为93.4%,并且获益可以见于各亚组人群。中位PFS未达到,1年的PFS率为53%。中位DOR(缓解持续时间)未达到,1年DOR率为69%。
安全性方面,3级及以上治疗相关AE(不良反应)发生率为20.9%,药物相关严重AE发生率为10.2%。2%的患者因AE而进行药物减量,药物相关死亡AE有4例。
目前,奥美替尼vs吉非替尼一线治疗EGFR突变的III期试验已经入组完毕,期待后续结果公布。
2. 恒瑞医药
产品:卡瑞利珠单抗
最高状态:已上市(经典型淋巴瘤)
患者标准:非鳞状NSCLC患者
入组人数:419例
疗效可评估人数:412例,卡瑞利珠单抗+化疗组(n=205)VS化疗组(n=207)
客观缓解率(ORR):60% VS 39.1%
疾病控制率(DCR):87.3% VS 74.4%
中位缓解持续时间(DoR):17.6 VS 9.9 month
总生存期(OS):未达到 VS 20.9
WCLC2019大会第一天摘要公布了卡瑞利珠单抗联合化疗(卡铂+培美曲塞)一线治疗晚期/转移性EGFR-/ALK-非鳞状非小细胞肺癌III期研究(NCT03134872)的中期分析积极数据。
在这项代号为SHR-1210-303的随机、开放、多中心、III期临床试验中,2017/5/12-2018/6/6期间入组的419例非鳞状NSCLC患者按照1:1随机分组,分别给予4-6个周期的化疗(卡铂 5AUC、培美曲塞500mg/m2)±卡瑞利珠单抗,之后使用培美曲塞±卡瑞利珠单抗维持治疗,直到疾病进展或出现不可耐受。对于化疗组中证实病情进展的患者,允许交叉使用卡瑞利珠单抗治疗。主要终点为独立数据监测委员会评估的PFS,次要终点包括ORR、DCR、DOR和OS。
结果显示,在中位随访时间为11.9个月,卡瑞利珠单抗+化疗组(n=205)的中位PFS较单独使用化疗组(n=207)显著延长(11.3 vs 8.3个月),到达主要终点。次要终点方面,卡瑞利珠单抗+化疗组的ORR、DCR、 DoR和OS均优于化疗组。安全性方面,卡瑞利珠单抗+化疗组和化疗组发生3/4级不良反应的比例分别为66.8%和51.2%;治疗相关的死亡人数分别为5和4例。
产品:阿帕替尼
最高状态:已上市(胃癌/胃食管癌)
患者标准:一线标准治疗后失败后的小细胞肺癌患者
入组人数:52例
疗效可评估人数:36例
客观缓解率(ORR):19.35%
疾病控制率(DCR):83.87%
中位缓解持续时间(DoR):未达到
中位无疾病进展期(PFS):未达到
中位生存期(OS):未达到
该研究是一项开放标签的非随机多中心临床研究,从2017年7月28日至2019年3月24日共纳入52例患者。入组患者为接受一线标准治疗后失败的SCLC患者,以评估阿帕替尼单药治疗SCLC的疗效及安全性。阿帕替尼的治疗剂量为500mg/d,主要研究终点为PFS,次要研究终点为OS、ORR、DCR及安全性。
纳入研究的52例患者中,36例患者可以进行疗效评估,中位PFS为6.18个月 (95%CI: 3.26-7.99个月),中位OS尚未达到。阿帕替尼二线治疗的PFS为6.48个月。一线化疗的PFS超过6个月的患者,接受阿帕替尼治疗时的PFS及OS均更好。患者的ORR和DCR分别为19.35%和83.87%。
治疗期间,共出现96例不良反应事件,其中3-4级不良反应事件及比例分别为:高血压(8.33%),手足综合征(5.56%)、乏力(5.56%)和蛋白尿(2.78%)。
3.正大天晴
产品:安罗替尼
最高状态:已上市
研究标题:ALTER 1202研究亚组分析:盐酸安罗替尼用于基线伴有脑转移的SCLC患者三线及以上治疗,来自多中心、随机、双盲、安慰剂对照的Ⅱ期研究
患者标准:至少接受过两种系统性化疗方案的局限期或广泛期SCLC患者
入组人数:30例
疗效可评估人数:30例 ,安罗替尼治疗组(n=21),安慰剂组(n=9)
中位无疾病进展期(PFS):3.84 VS 0.76 month
总生存期(OS):6.08 VS 2.56 month
符合条件的至少接受过两种系统性化疗方案的局限期或广泛期SCLC患者,以2:1比例随机接受盐酸安罗替尼(12mg,口服,D1-14, 21天为一个周期)或安慰剂治疗,直至肿瘤进展或出现药物不耐受。主要研究终点为PFS。本亚组分析基于基线时伴有脑转移的患者。
共有30例基线时伴有脑转移的患者,随机分为安罗替尼治疗组(n=21)和安慰剂组(n=9),与安慰剂相比,安罗替尼组显著改善患者PFS(3.84 VS 0.76个月;HR=0.15;95% CI,0.04-0.51;P=0.0005)和总生存期(OS)(6.08 VS 2.56个月;HR=0.26;95% CI,0.09–0.73;P=0.0061)。
安罗替尼治疗组最常见的不良事件包括食欲下降(47.62%)、体重减轻(42.86%)、血小板计数减少(38.10%)和高甘油三酯血症(38.10%);安慰剂组最常见的不良事件则为呕吐(44.44%)和食欲下降(33.33%)。
产品:安罗替尼
最高状态:已上市
研究标题:ALTER 1202研究亚组分析:评估盐酸安罗替尼在前线接受放化疗的晚期SCLC患者中的疗效,来自多中心、随机、双盲、安慰剂对照的Ⅱ期研究
患者标准:在前线接受放化疗的晚期SCLC患者
入组人数:120例
疗效可评估人数:120例 ,安罗替尼治疗组(n=82),安慰剂组(n=38)
中位无疾病进展期(PFS):5.49 VS 0.69 month
总生存期(OS):9.49 VS 4.89 month
该亚组分析评估了安罗替尼在前线接受同步、序贯或交替放化疗患者中的疗效。主要终点是PFS,次要终点包括OS、客观缓解率(ORR)、疾病控制率(DCR)和安全性。
2017年3月30日至2018年6月8日期间,共有120名符合标准的患者被随机分配到安罗替尼组(n=82)或安慰剂组(n=38)。其中,安罗替尼组和安慰剂组分别有46例和22例患者之前接受过放化疗。安罗替尼组和安慰剂组的中位PFS分别为5.49 VS 0.69个月(HR=0.14;P<0.0001)。对于前线接受放化疗的患者,与安慰剂相比,安罗替尼显著延长OS(9.49 VS 4.89 个月;HR=0.46;P=0.0388)。
安罗替尼组最常见的不良事件包括高血压(39.13%),体重减轻(39.13%),高甘油三酯血症(36.96%)和白细胞减少(30.43%)。最常见的3级及以上不良事件是高血压(15.22%),高甘油三酯血症(10.87%)和γ-谷氨酰转移酶升高(8.70%)。
4. 君实生物
产品:特瑞普利单抗
最高状态:已上市(黑色素瘤)
患者标准: EGFR-TKI治疗失败后的晚期伴EGFR+非小细胞肺癌患者(不包括T790M突变患者不包括奥希替尼治疗失败后的患者)
入组人数:40例
疗效可评估人数:31例
客观缓解率(ORR):54.8%
疾病控制率(DCR):93.5%
中位缓解持续时间(DoR):未达到
中位无疾病进展期(PFS):7.6个月
在本届WCLC 2019上,上海市肺科医院周彩存教授牵头开展的特瑞普利单抗联合化疗用于治疗EGFR-TKI治疗失败的EGFR+晚期非小细胞肺癌研究(NCT03513666)最新结果将在现场以口头汇报方式发布。
这是一项评估特瑞普利单抗联合化疗对EGFR-TKI治疗失败后的晚期伴EGFR+非小细胞肺癌患者(不包括T790M突变患者不包括奥希替尼治疗失败后的患者)有效性及安全性的前瞻性、多中心、开放、单臂、II期研究的结果。
在该研究中,患者接受每3周1次240mg或360mg固定剂量特瑞普利单抗+培美曲塞/卡铂治疗,最多6个周期,之后接受特瑞普利单抗+培美曲塞进行维持治疗,直至出现疾病进展或不可耐受的毒性,每6周评估一次疗效。主要终点为研究者基于RECIST v1.1标准评估的第12周的ORR,次要终点为基于RECISTv1.1 标准评估的DOR、DCR、TTR、PFS、OS以及安全性等。
该研究从2018年4月25日至2019年3月22日入组40例患者,女性占52.5%,中位年龄57岁。57.5%患者EGFR外显子19缺失,42.5%患者外显子21 L858R突变,仅有1例患者接受奥希替尼治疗后进展并有T790M突变。截至2019年4月3日,在31例可评估的患者中,观察到17例部分缓解和12例稳定疾病,ORR为54.8%,DCR为93.5%,中位PFS为7.6个月,DOR中位数未达到。
治疗相关不良事件(TEAE)发生率为86.5%,3级以上不良事件发生率为51.4%,包括1例死亡。最常见的AE包括白细胞减少症、中性粒细胞减少、血小板减少、贫血、恶心和食欲不振,10.8%的患者因AE导致治疗中断。结果显示,在EGFR-TKI治疗失败后的EGFR突变晚期NSCLC患者中使用特瑞普利单抗联合培美曲塞/卡铂治疗,具有良好的抗肿瘤疗效,目前已经开展相关III期注册研究(CTR20190768)。
5. 信达生物
产品:信迪利单抗+安罗替尼
患者标准: 一线治疗驱动基因(EGFR/ALK/ROS1)阴性晚期非小细胞肺癌(NSCLC) 患者
入组人数:22例
疗效可评估人数:18例
客观缓解率(ORR):68.2%
疾病控制率(DCR):100%
WCLC 2019召开的第一天,上海市胸科医院韩宝惠教授口头汇报了信迪利单抗联合安罗替尼一线治疗驱动基因(EGFR/ALK/ROS1)阴性晚期非小细胞肺癌(NSCLC) 的Ⅰ期临床研究结果。
该研究从2018年9月至2019年2月入组22例患者,男性占95.5%,63.6%的患者有吸烟史,鳞癌占54.5%,4例患者合并脑转移。同时21例中进行了PD-L1表达检测;18例患者进行了肿瘤突变负荷(TMB)检测。
数据截止2019年7月3日,16例患者确认为部分缓解(PR),6例患者疾病稳定(SD),ORR达72.7%(49.8%~89.3%),DCR为100% (84.6%~100%)
数据截止时,81.8%(18/22)的患者仍在接受治疗中,仅2例患者发生PFS事件,PFS数据尚不成熟,预估6个月 PFS率为93.8%(95%CI:63.23%~99.10%)。
另外值得注意的是,总共40.9%(9/22)的患者治疗后出现肿瘤内空洞形成,其中4例患者为确认的PR,5例患者疗效为SD。
安全性上,所有患者接受信迪利单抗联合安罗替尼治疗耐受性良好,未观察到意料之外的毒性;≥3级治疗相关不良事件发生率为27.3%(6/22),且多数可逆可控。
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..