如何使用其他T细胞选择性地靶向和摧毁癌性T细胞?这个问题一直困扰着希望将CAR-T细胞疗法应用于T细胞癌的研究人员。
总部位于圣路易斯的生物技术公司Wugen正在通过开发针对T细胞癌症的第一种同种异体CAR-T疗法来填补这一治疗缺口。
据美国癌症协会称,有许多类型的T细胞癌,但它们都相对罕见,例如,T细胞癌占非霍奇金淋巴瘤的比例不到15%。
一种类型的T细胞癌是T细胞急性淋巴细胞白血病(T细胞ALL),是癌的不常见形式,其中癌细胞是前体T细胞。T细胞ALL占所有类型ALL的15-25%,仅占所有淋巴瘤的1%(淋巴系统的癌症,包括称为淋巴细胞的某些白细胞)。虽然T细胞ALL存活率一直在攀升,现在与B细胞ALL率(约85%)相当,但对于复发性疾病来说,T细胞ALL仍然具有较高的复发率和较低的存活率(低于25%)。
目前T细胞ALL的治疗选择包括化疗、放射治疗和骨髓移植(也称为干细胞移植),骨髓移植是最好的治疗选择。目前还没有FDA批准的针对T细胞癌的靶向治疗。
CAR-T治疗T细胞癌的挑战
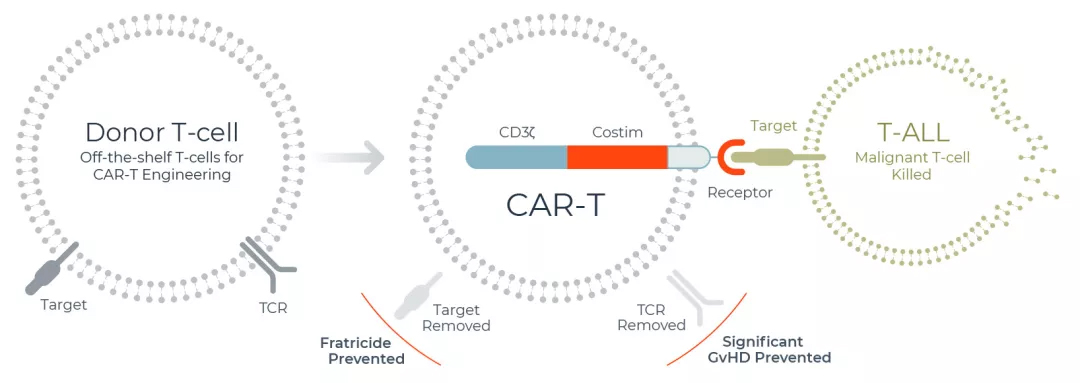
开发用于T细胞癌症的CAR-T治疗平台具有其自身独特的挑战。无论是健康的T细胞还是癌T细胞,所有T细胞都表达相同的表面蛋白,称为抗原。为了开发针对T细胞癌的CAR-T疗法,将CAR-T细胞重编码以靶向这些T细胞特异性抗原中的一种。
因为CAR-T细胞是T细胞的修饰类型,它们也表达与它们靶向的癌性T细胞相同的抗原。这将导致CAR-T细胞识别并相互靶向,导致CAR-T细胞的自杀,这会使CAR-T细胞过少而无法杀死患者的癌细胞,从而限制了CAR-T疗法的有效性。
为了产生针对癌性T细胞的CAR-T细胞,必须从CAR-T细胞本身除去CAR-T细胞靶向的T细胞抗原,使它们不会相互攻击。通过去除CAR-T细胞彼此识别为敌人的能力,这使得CAR-T细胞能够持续更长时间并且对抗癌性T细胞更具活性。
自体(或患者衍生的)CAR-T细胞对于抗T细胞癌具有挑战性。当从病人的血液中提取T细胞来制造CAR-T细胞时,要从健康细胞中完全纯化癌细胞是非常困难的。这就有可能在CAR-T细胞治疗中无意中留下一些癌变T细胞,这可能会将癌变T细胞重新引入病人体内,并产生耐治疗细胞。
事实上,这种情况发生在一个B细胞ALL的病人身上,他接受了自体抗CD19 CAR-T治疗Kymriah,但9个月后因表达抗CD19 CAR的癌性B细胞复发。在Kymriah的制造过程中被无意中植入了一个癌性B细胞,并在治疗过程中被重新引入病人体内。这些表达CAR- 19的抗癌B细胞躲过了CAR-T细胞的攻击,因为在每一个癌细胞上,抗CD19的细胞都与表面的CD19结合,这使得CAR- T细胞无法结合并摧毁表达CAR-19的癌细胞。不幸的是,这个病人死于CAR-T耐药癌细胞的增殖。
因此,靶向T细胞癌症的唯一可行方法是使用同种异体(或健康供体衍生的)CAR-T疗法,其中来自健康供体的T细胞被修饰以用于多个患者。
健康的T细胞和恶性T细胞具有相同的表面蛋白(靶抗原)
然而,同种异体疗法需要克服自身的一系列挑战,即危及生命的副作用,称为移植物抗宿主病(GvHD)。当供体CAR-T细胞将患者的细胞识别为外来并攻击它们时,发生GvHD。
大多数其他针对B细胞癌的CAR-T疗法,以及所有针对T细胞癌的CAR-T疗法都是自体的,这使得针对T细胞癌的CAR-T疗法成为一个待填补的理想的治疗方式。
开发第一种同种异体CAR-T治疗T细胞癌
Wugen的联合创始人兼CSO Matthew Cooper受到启发,专注于那些患有T细胞ALL的患者,当他们听说患有罕见T细胞癌的患者接受治疗没有治疗方案时,他们决定开发这种疗法。
Wugen的CAR-T细胞被基因编辑以去除T细胞特异性靶抗原(降低自杀能力并使其更有效)和T细胞受体(降低GvHD风险)。
到目前为止,Wugen正在开发两种同种异体CAR-T疗法:WU-CART-007,其靶向T细胞抗原CD7; 和WU-CART-002,其靶向T细胞抗原CD2。从CAR-T细胞中除去靶抗原:从WU-CART-007细胞中除去CD7,从WU-CART-002细胞中除去CD2。
WU-CART-007 正在开发用于治疗复发和难治性T细胞ALL和其他非霍奇金T细胞淋巴瘤。选择CD7作为靶标,是因为它在许多类型的T细胞癌上表达。它也在大多数自然杀伤(NK)非霍奇金淋巴瘤和白血病中表达,以及约25%的急性髓性白血病(AMLs)中表达,这意味着它可用于靶向其他类型的T细胞和NK癌症。
为了产生WU-CART-007细胞,使用CRISPR / Cas9以高精度去除CD7抗原和T细胞受体(特别是α链)-约95%的所得CAR-T细胞缺乏这两种受体。Wugen的灵感来自于成功的UCART19(由Allogene和Servier开发)的首次人体试验,这是一种通过移除T细胞受体的α链而产生的CAR-T基因疗法。
在多个T细胞ALL细胞系中,WU-CART-007以特定靶点的方式平均杀死了95%的T细胞。在患有T细胞ALL的小鼠中,首先测试不含T细胞受体的T细胞,以评估它们诱导GvHD的能力。这些T细胞没有诱导GvHD;通过移除T细胞受体,信号被停止,CAR-T细胞不再能识别为外来的,有效地预防了GvHD。
在接受WU-CART-007的T细胞ALL小鼠中,他们的血液中未检测到T细胞ALL细胞。令人兴奋的是,注射后6周,血液中仍可检测到WU-CART-007细胞。这种在小鼠中长期存在的现象可以归因于去除CD7靶抗原和防止CAR-T细胞的自我杀伤。
CAR-T治疗的主要严重副作用预计是T细胞再生障碍,患者的T细胞数量较低或没有T细胞,因为使用WU-CART-007治疗的小鼠出现了T细胞再生障碍。CAR-T针对的是特定的T细胞特异性抗原,健康的T细胞和癌变的T细胞都表达了目标抗原,因此CAR-T细胞会不加选择地杀死患者的所有T细胞。T细胞再生障碍也是骨髓移植后常见的严重副作用。长期的T细胞发育不良问题的一个潜在解决方案是在CAR-T中设置所谓的“自杀基因”,其可以被打开并使CAR-T细胞在特定时间死亡。
结语
到目前为止,临床前研究表明,Wugen的平台是同种异体T细胞治疗T细胞癌症临床可行的方法。虽然到目前为止所有的工作都是临床前的,但Wugen目前正在计划一项WU-CART-007的临床试验,治疗复发和难治的CD7 T细胞ALL,预计将于明年年初开始。
据Cooper评论说,Wugen的同种异体CAR-T策略是“T细胞恶性肿瘤唯一临床可行的策略”。这种治疗方法可以为没有其他选择的患者提供治疗选择。望明年年初将要开展的临床试验可以提供最新的数据来填补这一缺口。
来源:医麦客 作者: 杨姗琳
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..