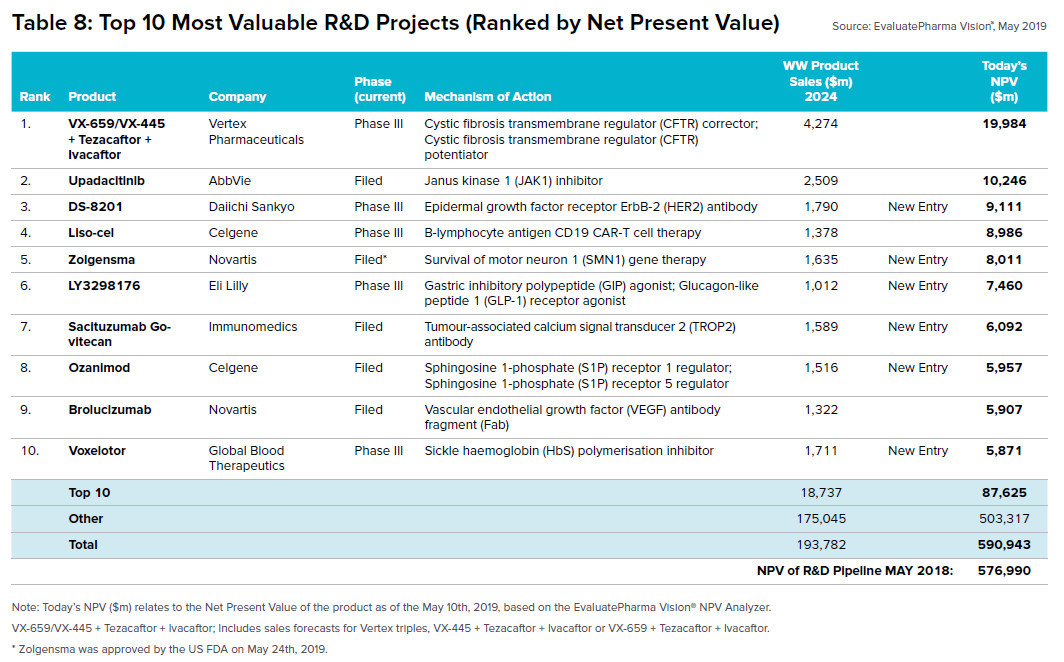
日前,EvaluatePharma发布了对生物医药行业未来发展的预测报告,在报告中,该机构根据其专有算法,公布了最有价值的10大临床后期研发项目。这些研发项目都有在2024年成为重磅新药的潜力。今天,药明康德的内容团队将与读者分享这10大潜在重磅药的相关信息。
图片来源:参考资料[2]
VX-445+Tezacaftor+Ivacaftor
适应症:囊性纤维化(Cystic Fibrosis)
公司:Vertex Pharmaceuticals
Vertex公司日前选定该公司的在研疗法VX-445,与已获批疗法Tezacaftor和Ivacaftor构成3联疗法,治疗囊性纤维化。囊性纤维化是由于编码囊性纤维化跨膜电导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)的基因发生突变,导致CFTR蛋白缺失或功能缺陷引起的遗传病。
VX-445是新一代CFTR蛋白矫正剂,它用于恢复携带F508del突变的CFTR蛋白的功能,从而改善CF患者的呼吸功能。它与Tezacaftor和Ivacaftor构成的3联组合疗法已经达到3期临床试验终点。这一组合疗法可能治疗90%的囊性纤维化患者。该公司计划在今年第三季度向美国FDA递交新药申请(NDA)。
Upadacitinib
适应症: 类风湿关节炎
公司:艾伯维(AbbVie)
艾伯维开发的upadacitinib是一款第二代JAK抑制剂,对JAK1亚型具有高度选择性。JAK激酶家族抑制剂在治疗炎症性和自身免疫疾病(例如类风湿性关节炎和克罗恩病)方面已经显示出卓越的疗效。
Upadacitinib治疗类风湿性关节炎的新药申请已经在今年2月获得FDA授予的优先审评资格。近日公布的最新临床试验结果表明该疗法能够长期缓解患者症状,并且疗效优于现有常见疗法。
Trastuzumab deruxtecan(DS-8201)
适应症: HER2+转移性乳腺癌、胃癌
公司:第一三共(Daiichi Sankyo),阿斯利康(AstraZeneca)
由第一三共和阿斯利康联合开发的trastuzumab deruxtecan(DS-8201)是一款靶向HER2受体的创新抗体偶联药物(ADC)。它使用了第一三共开发的创新抗体偶联技术,让靶向HER2的抗体上能够连接更多细胞毒素,从而增强杀伤肿瘤的效果。这款ADC在治疗HER2+转移性乳腺癌患者的临床试验中达到93.7%的疾病控制率。
第一三共计划在今年下半年递交针对晚期或转移性乳腺癌的监管申请,同时,两家公司也在进行其它临床试验,探索这一ADC在治疗表达HER2的其它癌症方面的疗效。
Liso-cel(全名lisocabtagene maraleucel ,又名JCAR017)
适应症: 复发难治性(R/R)慢性淋巴性白血病(CLL),小淋巴细胞淋巴瘤(SLL)
公司:新基(Celgene)
新基旗下Juno Therapeutics公司开发的liso-cel是一款靶向CD19的CAR-T疗法,它使用了4-1BB共刺激域。在刚刚结束的美国临床肿瘤学会(ASCO)年会上,新基公司公布了这款疗法1/2期临床试验的最新结果,在接受过多种前期疗法(包括ibrutinib)的R/R患者中,这款CAR-T疗法达到82%的ORR和46%的完全缓解率(CR)。
值得注意的是,在20名接受微小残留病灶(MRD)检测的患者中,75%患者的血液MRD水平为阴性,65%患者的骨髓MRD水平为阴性。
Zolgensma(onasemnogene abeparvovac-xioi)
适应症: 脊髓性肌肉萎缩症(SMA)
公司:诺华(Novartis)
这款创新基因疗法已经在近日获得FDA批准,治疗1型SMA患者。它是美国FDA批准的第一款治疗SMA的基因疗法。
这款最初由AveXis公司开发的基因疗法,将表达正常运动神经元生存蛋白(SMN)的SMN1转基因通过AAV9病毒载体导入患者体内,让患者细胞能够长期表达SMN蛋白,从而达到“治愈性”效果。
值得一提的是,临床试验结果表明,这款基因疗法不但能够挽救症状最严重的1型SMA患者的生命,而且可以改善症状相对较轻的2型和其它类型SMA患者的运动能力。
Tirzepatide(LY3298176)
适应症: 2型糖尿病, 非酒精性脂肪肝炎(NASH)
公司:礼来(Eli Lilly and Company)
礼来公司开发的tirepatide(LY3298716)是一款多肽类药物,具有胃抑制多肽(GIP)受体和胰高血糖素样肽-1(GLP-1)受体双重激动剂的功能。这款在研新药可以提高胰腺β细胞功能,提高患者的胰岛素敏感性。
近日在美国第79届糖尿病协会(ADA)大会上公布的临床试验数据表明,tirzepatide能够导致患者糖化血红蛋白(A1C)水平和体重显著下降。而且,tirzepatide在治疗2型糖尿病患者的过程中还能够改善与NASH相关的生物标志物水平。

图片来源:参考资料[6]
Sacituzumab Govitecan
适应症: 实体瘤
公司:Immunomedics
Sacituzumab Govitecan是一款创新ADC。它将靶向TROP-2抗原的单克隆抗体与名为SN-38的细胞毒性药物连接起来。TROP-2是在许多人类肿瘤细胞表面过量表达的受体,在正常组织中表达水平有限。SN-38是一种抗癌化疗药物的活性代谢产物。这款疗法已经获得FDA授予的突破性疗法认定,治疗难治性三阴性乳腺癌(TNBC)患者。同时FDA授予了它快速通道资格,治疗TNBC、NSCLC和小细胞肺癌(SCLC)患者。
Ozanimod
适应症: 多发性硬化症(MS)
研发公司:新基(Celgene)
Ozanimod是一款新型口服选择性鞘氨醇1-磷酸(S1P)受体调节剂,与S1P1和S1P5这两类受体亚型有选择性的高亲和性。在淋巴组织中,ozanimod能促进淋巴细胞的驻留,从而减少前往中枢神经系统的淋巴细胞数目,从这一方面缓解多发性硬化症的症状。
在两项3期临床试验中,ozanimod能够降低MS患者的年复发率。这款新药的上市申请已经获得美国FDA和欧盟EMA的接受,预计在2020年上半年将获得回复。
Brolucizumab
适应症:湿性年龄相关性黄斑变性(湿性AMD)
公司:诺华
Brolucizumab是一款人源化单链抗体可变区片段,能够以高亲和力与所有VEGF-A蛋白结合,抑制它们的功能以及VEGF受体的激活。湿性AMD患者由于黄斑下出现异常血管增生,以及这些血管渗出液体,导致视网膜结构受损。通过抑制VEGF信号通路,brolucizumab可以抑制新生血管病变的增长,清除视网膜积水,改善患者视力。
在两项3期临床试验中,brolucizumab与标准疗法相比,在改善患者视力方面达到非劣效性,在改善患者视网膜积水方面,优于标准疗法。诺华在今年4月已经使用优先审评券向FDA递交了新药申请,如果获得批准,有望年末推出这款创新疗法。
Voxelotor
适应症:镰状细胞贫血(SCD)
公司:Global Blood Therapeutics(GBT)
Voxelotor是一款口服小分子药物。它可以帮助血红蛋白更好地结合氧气,抑制镰状血红蛋白的多聚化,从而防止血细胞镰刀状变形过程的发生,进而改善溶血性贫血。这款创新疗法已经获得FDA授予的突破性疗法认定,并且获得FDA批准,使用加速批准通道递交新药申请。
近日公布的3期临床试验结果表明,voxelotor能够显著提高SCD患者的血红蛋白水平。GBT公司计划在今年下半年完成voxelotor的滚动新药申请。
参考资料:
[1] Innovation and Unmet Need Drive Prescription Drug Sales to $1.18tr by 2024: New Report from Evaluate Ltd. Retrieved June 17, 2019, from https://www.businesswire.com/news/home/20190604005091/en/Innovation-Unmet-Drive-Prescription-Drug-Sales-1.18tr
[2] EvaluatePharma World Preview 2019, Outlook to 2024. Retrieved June 17, 2019, from https://www.evaluate.com/thought-leadership/pharma/evaluatepharma-world-preview-2019-outlook-2024
[3] Vertex Selects Triple Combination Regimen of VX-445, Tezacaftor and Ivacaftor to Submit for Global Regulatory Approvals in Cystic Fibrosis. Retrieved June 18, 2019, from https://investors.vrtx.com/news-releases/news-release-details/vertex-selects-triple-combination-regimen-vx-445-tezacaftor-and
[4] Celgene Corporation Announces Initial Phase 1/2 Liso-cel Data in Patients with Relapsed/Refractory CLL, Including Those with High-Risk Disease, Previously Treated with Ibrutinib, at ASH 2018. Retrieved June 18, 2019, from https://ir.celgene.com/press-releases/press-release-details/2018/Celgene-Corporation-Announces-Initial-Phase-12-Liso-cel-Data-in-Patients-with-RelapsedRefractory-CLL-Including-Those-with-High-Risk-Disease-Previously-Treated-with-Ibrutinib-at-ASH-2018/default.aspx
[5] Celgene Announces Data from Ongoing Studies of Liso-Cel in Patients with Difficult-to-Treat Blood Cancers at ASCO 2019. Retrieved June 18, 2019, from https://ir.celgene.com/press-releases/press-release-details/2019/Celgene-Announces-Data-from-Ongoing-Studies-of-Liso-Cel-in-Patients-with-Difficult-to-Treat-Blood-Cancers-at-ASCO-2019/default.aspx
[6] Eli Lilly and Company Diabetes 2019 Business Update. Retrieved June 18, 2019, from https://investor.lilly.com/static-files/a5dbe9fa-f45f-41ef-bc16-bc12be6dd606
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..