2018年,美国FDA共批准了59款新药,是近26年来新药核准数量最多的一年,从一个侧面反映出美国政府优化法规监管、加速新药上市的政策倾向。

图1 1993—2018年美国FDA新药批准数量
数据来源:FDA官方网站数据
一、美国新药特殊审评制度概况
美国从自身国情出发,设立了多种新药特殊审评模式。FDA主要有四种新药加快审批途径,分别是快速通道、加速审批、突破性疗法和优先审评。
1.快速通道:针对治疗严重疾病且目前临床用药空缺的新药
严重疾病包括代表性的艾滋病、心衰、癌症和阿尔茨海默病,以及癫痫、抑郁和糖尿病等。解决尚未满足的医疗需求指提供一种新的治疗药物或优于现有药物的治疗药物。
药企主动提出快速通道指定申请,可与临床研究申请(IND)一同提出,或在IND提交后任何时候提出,但建议在生物制品许可申请(BLA)或新药申请(NDA)会议之前,FDA在收到申请后60天内给出答复。快速通道需要提供非临床和临床数据,表明该药具备解决医疗需求不足的潜力。满足医疗需求不足可分为提供目前没有的治疗药物或提供优于现有治疗的药物。
2.加速审批:针对目前临床用药空缺、基于替代终点而批准的新药
满足以下三个条件可获得加速审批:一是用于治疗严重疾病,二是对于现有疗法具有优势,三是显示具有改善代理终点表现的新药。
申请人应在新药研发过程中与FDA审评人员沟通,探讨可否应用代理终点指标,以及验证性临床试验(指在新药批准后的临床试验)等有关问题。FDA回应加速审批申请的时限并无明确规定。
3.突破性疗法:针对明显改善现有疗法的新药
满足以下两个条件可认定为突破性治疗药物:一是适应证为危及生命的或严重的疾病,二是有证据显示在某一重要临床终点上明显优于现有药物。
制药企业可将突破性治疗药物资格申请与IND一同提交,或在IND提交后任何阶段,但建议不晚于Ⅱ期临床试验会议结束,FDA在收到申请60天内给予答复。如果该药物不再满足突破性治疗药物指定的资格,FDA将撤销对其的指定。突破性治疗药物需要提供初步的临床证据表明该药能够实质性改善现有治疗药物的临床终点。
4.优先审评:在申请受理后6个月内完成审评的新药
优先审评适用于治疗严重疾病且一旦获得批准,对现有疗法的安全性或有效性改善显着的新药(可以是首次新药申请,也可以是已上市药品的疗效补充申请),也适用于认定为抗感染的新药或治疗某些热带疾病的新药。
在递交新药生产申请(NDA)、或生物制品生产申请(BLA)、或递交相关补充申请时,申请优先审评。FDA在收到申请60天内给予答复,并于6个月内完成审评。
二、美国新药特殊审评模式对于我国的借鉴
1.我国新药特殊审评制度的沿革
近年来我国出台一系列文件,建立和完善新药特殊审评制度。
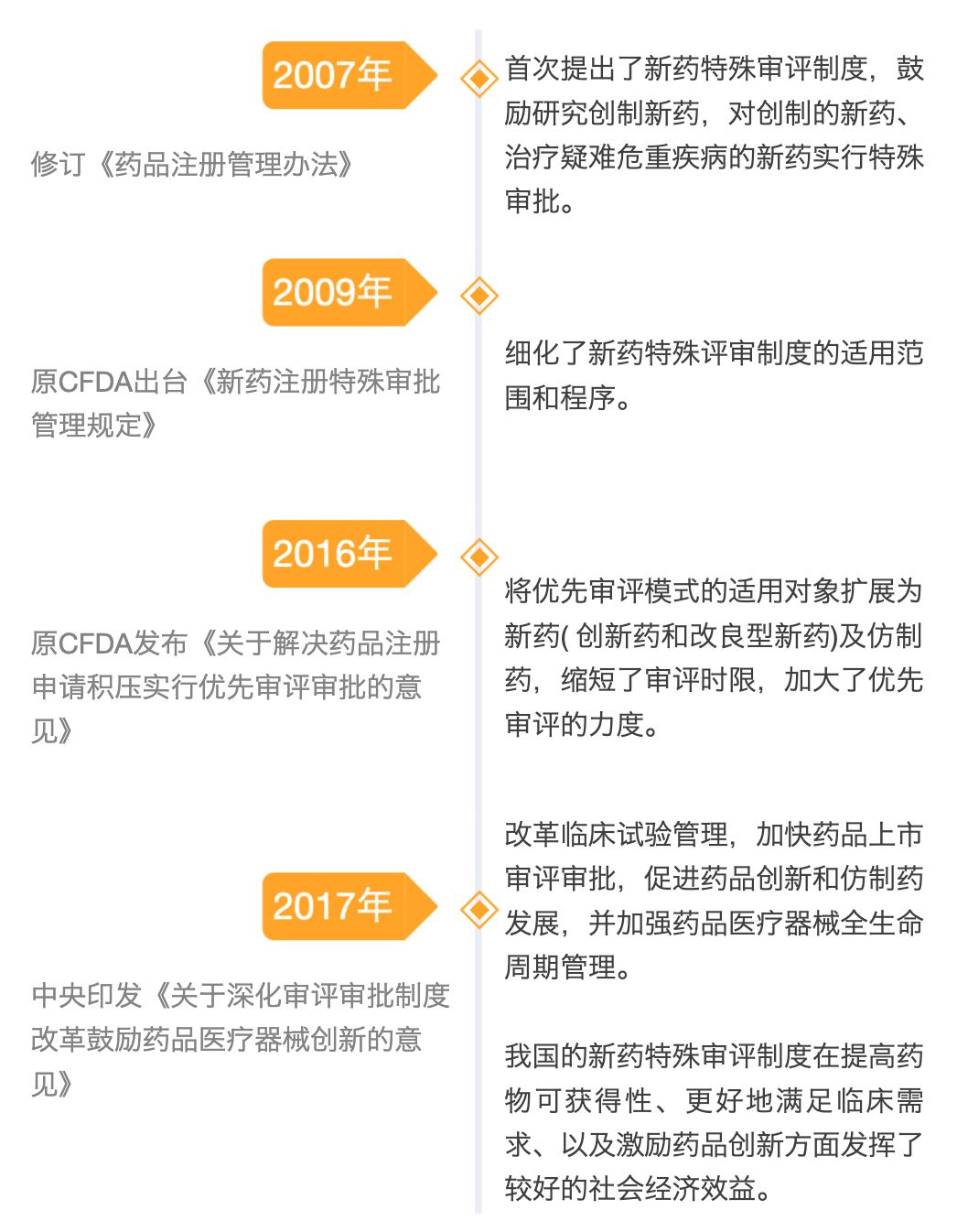
图2 我国新药特殊审评制度沿革
(根据公开资料整理)
2.美国新药特殊审评制度对于我国的借鉴
从作用机制来看,我国与美国采用的审评机制大体相同,即为优先审评的新药优先配置资源。由于美国新药特殊审评制度建立较早,相对更为成熟,对于我国具有不少可供借鉴之处:
(1)通过细化关键审评步骤的时间节点加快审评速度。美国的新药特殊审批制度中设置了归档会议、中期会议等几个重要审评节点,从而缩短新药审批用时。
(2)实行新药审评项目经理制度,减少沟通成本,提高审评效率。美国设立新药审评项目经理,由其联系、协调申请人与审评机构,推动审评工作顺利进行。
(3)建立细分领域的专业审评室,增强审评的专业性和科学性。美国根据适应证的不同,建立了血液学和肿瘤、代谢和内分泌等多个审评办公室。各审评室由项目经理、药理/毒理学专家、临床药理学/生物药剂学专家、化学家/生物学家专家、医务人员、统计学专家组成。通过不同领域专家的充分交流与通力合作,保证审评决策的科学性。
三、完善我国新药特殊审评制度的建议
1. 设置更为明确的新药特殊审评时间节点
目前的新药特殊审评制度对于药品检验、现场检查和沟通交流的时限作出了一些规定,但对于整个技术审评时限尚未明确,制度实施上具有一定的随意性。
建议设置特殊审评整体审评时限,明确“立卷审查”、“技术审评报告”、“三合一综合审评”、“获批上市”等重要节点的审评时限,同时加大各机构之间的沟通协调力度,缩短新药特殊审评的周期。
2. 优化新药特殊审评适用范围的分类标准
当前我国新药特殊审评制度适用范围的分类标准仍不够清晰。既有根据适应证和结构的分类标准,还包含了国家重大新药创制专项和国家重点研发计划的药品和主动撤回重新申报的品种。
今后应进一步明确适用范围的分类标准,避免各种不同类别的申请都拥挤在同一通道,一定程度上增加了监管难度。可考虑对于创新药和改良型新药按照新药通道管理,临床急需的首仿药按照仿制药通道管理,从源头上对创新药和仿制药实施差异化管理。由于短时期内我国创新药数量相对较少,建议加大对于改良型新药的重视,适当提高改良型新药的占比。
3. 加强新药特殊审评相关配套制度的建设
继续探索建立新药特殊审评项目管理人制度,扩大项目管理人的职能范围,与审评团队共同负责审评过程,协调申请人与审评机构之间的交流,管理相关审评文件,充分参与审评过程中各个环节的工作。
探索成立以临床审评人员为核心,药理、毒理、药学和统计等多专业审评人员与项目管理人员共同参与的适应证专业审评团队,提高审评决策的科学性和合理性。
来源:火石创造 作者:刘宇
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..