Karyopharm Therapeutics是一家临床阶段的制药公司,专注于发现和开发针对核转运及相关靶标的首创新型疗法,用于治疗癌症及其他重大疾病。目前,该公司靶向抗癌药selinexor的新药申请(NDA)正在接受美国FDA的优先审查,处方药用户收费法(PDUFA)目标日期为2019年4月6日。该NDA旨在申请
FDA加速批准selinexor与地塞米松联合用药方案,用于既往已接受至少3种疗法且其疾病对至少一种蛋白酶体抑制剂(PI)、一种免疫抑制剂(IMiD)、一种抗CD38单克隆抗体难治的复发难治性多发性骨髓瘤(RRMM)患者。目前,selinexor也正在接受欧洲药品管理局(EMA)的加速评估。在美国和欧盟,selinexor均被授予了孤儿药资格,在美国还被授予了快速通道资格。
不过,就在最近,selinexor在美国的监管审查传来了不利消息。
FDA上周末发布简报材料,对selinexor的安全性提出了质疑。简报材料发布后,Karyopharm公司股价在在周五交易中暴跌近40%。不过本周一开盘后,该公司股价已回升了5%。
在简报材料中,FDA指出selinexor治疗与严重的毒性作用相关。根据简报材料中的数据,在临床研究中有23例患者在selinexor治疗后30天内死亡,其中13例死于疾病进展,10例死于致命性的治疗中出现的不良事件(TEAE)。
FDA指出,研究中所有患者至少经历了一次TEAE。数据显示,93.5%的患者至少经历了一次严重的TEAE,60.2%的患者至少经历了一次严重的不良事件。此外,大多数患者(88.6%)因TEAE至少需要一次剂量调整,28.5%的患者因TEAE永久中断selinexor治疗。
此外,FDA简报数据指出,对患者所建议的起始剂量耐受性不好,数据提示剂量限制毒性。除了安全问题,
FDA还提出了
临床试验设计方面的问题。支持selinexor NDA的临床研究STORM是一项单组研究,评估了selinexor与低剂量地塞米松的联合用药方案,其中没有纳入对照组。
简报文件指出:“鉴于历史研究表明,在一项I期研究KCP-330-001中,高剂量地塞米松治疗RRMM的的缓解率为10-27%,而selinexor并没有表现出单药治疗活性,因此很难分离出selinexor的治疗效果。”
FDA指出,RRMM的治疗很棘手,主要是因为缓解期随着之后的每一种治疗方法而缩短,对目前可用的主要类别的抗骨髓瘤疗法难治的患者,预后非常差。
FDA表示,目前已有9种药物被批准专门用于治疗RRMM,自2015年以来已批准了4种新药或生物制剂。
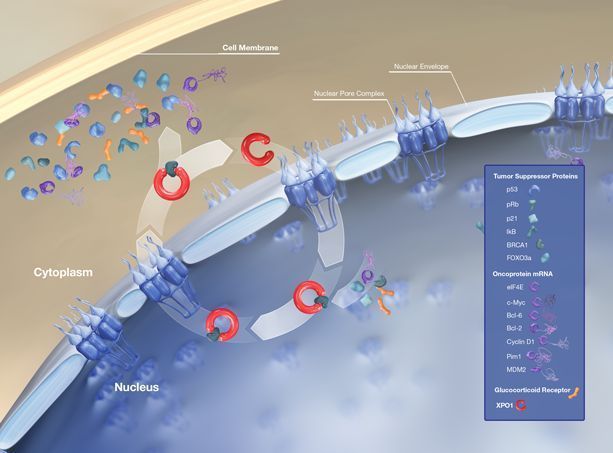
XPO1介导核转运
selinexor是一种首创、口服、选择性核输出抑制剂(SINE)化合物,通过结合并抑制核输出蛋白XPO1(又名CRM1)发挥作用,导致肿瘤抑制蛋白在细胞核内积累,这将重新启动并放大它们的
肿瘤抑制功能,导致癌细胞选择性凋亡,同时不会对正常细胞造成显著影响。
selinexor监管文件的提交是基于IIb期研究STORM的数据。该研究是一项国际性、多中心、单组研究,评估了selinexor联合低剂量地塞米松的疗效和安全性。研究入组了122例既往已过度治疗且对目前可用的3类难治性MM疗法中所有5种药物产生耐药的RRMM患者。研究中,患者接受selinexor(80mg,口服,每周2次)联合低剂量地塞米松(20mg,每周2次)治疗。
数据显示,selinexor与低剂量地塞米松联合用药方案的总缓解率为26.2%,包括2例严格的完全缓解(sCR)、6例非常好的部分缓解(VGPR)、24例部分缓解(PR),该方案的中位缓解持续时间为4.4个月。安全性方面,最常见的不良事件包括血小板减少、恶心/呕吐、疲劳和食欲下降。不良事件通常是可预测的,并且通过剂量调整是可控制的。26.8%的患者因TEAE停止治疗,这些患者中有17.9%的患者被研究人员认为与治疗相关。主要器官毒性在该研究中并不突出,安全性结果与STORM研究的第1部分以及其他selinexor研究报告的结果一致。
迄今为止,在临床研究中已有超过2500例患者接受了selinexor的治疗。目前,Karyopharm公司也正在多个中期、晚期临床研究中评估selinexor治疗一系列血液系统恶性
肿瘤和实体瘤的潜力,包括多发性骨髓瘤(3个临床研究:BOSTON,STORM,STOMP)、弥漫性大B细胞淋巴瘤(SADAL研究)、脂肪肉瘤(SEAL研究)、子宫内膜癌(SIENDO研究)、胶质母细胞瘤(KING研究)。(生物谷Bioon.com)