据FDA官网提供的最新公布结果,FDA在2018年前十个月中已经陆续批准了47款新药,包括34个新分子实体和13个新生物制品,新药数量已创近20年历史新高。预计整个2018年FDA将批准至少50款新药,有望追平甚至超越1996年的历史最高纪录,这也是医药界的一个丰收年。
图1:美国CDER1995-2018年批准的新药数量
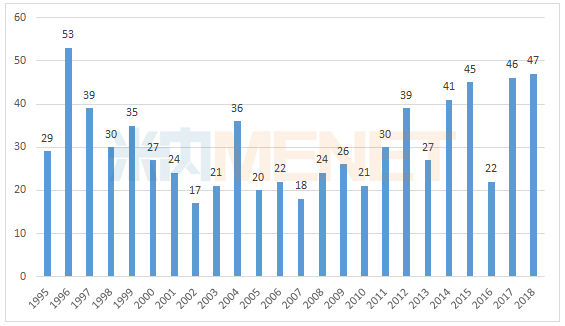
(数据来源:米内网综合整理)
表1:十月再批六款新药,涉及多个疾病领域

(数据来源:米内网综合整理)
获批的六款新药中,包含5个新分子实体和1个新生物制品,涉及多个疾病领域。其中两款抗生素的批准体现出美国FDA对抗菌药物研发的重视,也给该领域的研发注入了一剂强心针。两款孤儿药TEGSEDI和REVCOVI的获批也是体现出美国对罕见病患者的重视;TALZENNA是第四款获批的PARP抑制剂,给乳腺癌患者带来了新的治疗选择;XOFLUZA被誉为最强抗流感神药,它的获批给面临流感威胁的大众带来了非常安全有效的治疗选择。
一、呵护你的美,抗痤疮新药:SEYSARA
2018年10月1日,美国FDA批准了艾尔健旗下新药Seysara(sarecycline)上市,用于9岁及以上非结节性中度至重度寻常痤疮患者治疗炎性病变。Seysara是一种首创(first-in-class)、窄谱四环素衍生抗生素,具有较强的抗炎作用。在临床研究中已被证明在开始用药后3周内可使皮肤炎性病变实现统计学意义的显著改善减少,并且具有良好的安全性和耐受性。Seysara的获批,将为中度至重度痤疮患者提供一种创新的治疗选择。

Seysara由抗生素公司Paratek发现,并将该产品在美国市场的独家权利授予了艾尔建,同时保留该产品在全球其他地区的开发和商业化权利。今年8月初,Almirall宣布以5.5亿美元收购艾尔建在美国的医疗皮肤病部门的5款产品,包括4款成熟品牌以及这款首创级别的创新性四环素衍生抗生素Seysara。Almirall首席执行官Peter Guenter表示,我们很自豪获得了FDA对Seysara的批准,该药将为医疗需求未满足的众多患者带来新的选择,同时预计Seysara的年销售峰值将达到1.5-2亿美元。
二、新型广效型抗生素:NUZYRA
2018年10月2日,美国FDA批准Paratek Pharmaceuticals公司旗下新型抗生素Nuzyra(omadacycline)上市,用于社区获得性细菌性肺炎(CABP)和急性细菌性皮肤和皮肤结构感染(ABSSSI)成人患者的治疗。

Nuzyra是一种新型抗生素,具有每日一次IV和口服两种制剂,可用于治疗CABP、ABSSSI和尿路感染(UTI)。作为一种现代化的四环素,Nuzyra可以克服四环素的抗性,并在广谱细菌中表现出活性,包括革兰氏阳性菌、革兰氏阴性菌、厌氧菌、非典型细菌和其他耐药菌株。
Nuzyra的获批,是基于3个III期临床研究的数据,这些研究评估了每日一次口服或静脉输注剂型Nuzyra治疗ABSSSI和CABP的疗效和安全性。这些研究入组了近2000例患者,所有3个研究中,Nuzyra均达到了FDA指定的主要终点和次要疗效终点,并且耐受性良好。该药具有不错的市场前景,预计未来五年销售额峰值能达到3.5亿美元。
三、反义RNA新药:TEGSEDI
2018年10月5日,美国FDA批准Ionis Pharmaceuticals旗下新药Tegsedi(inotersen)上市,用于遗传性甲状旁腺素淀粉样变性(HATTR)患者的多发性神经病变。值得一提的是,Tegsedi是全球首个获批治疗hATTR的药物,已经在美国、欧盟和加拿大获得批准。

Tegsedi是一种反义寡核苷酸(ASO)药物,可抑制TTR蛋白(包括突变型和野生型)的生成,为hATTR淀粉样变性引起的多发神经病患者提供有效地治疗。在临床研究中,该药治疗大大降低了TTR蛋白水平。在用药方面,Tegsedi具有每周一次、自我皮下注射的便利性;且在治疗hATTR方面具有良好的效益风险,患者神经病变和生活质量方面获得实质性改善,并与TTR突变类型、疾病分期或心肌病存在均无关。
在一项名为NEURO-TTR的三期临床中,Tegsedi的安全性和有效性均得到数据的充分支持。该药的优秀表现使其拥有不错的市场前景,预计未来五年销售额峰值为4.2亿美元。
四、“泡泡男孩病”新药:Revcovi
2018年10月5日,美国FDA批准意大利生物制药公司Leadiant Biosciences旗下新药Revcovi(elapegademase-lvlr)上市,用于腺苷脱氨酶重症联合免疫缺陷症(ADA-SCID)儿童及成人患者的治疗。ADA-SCID又被称为“泡泡男孩病”(bubble boy disease),这是一种超罕见且极具破坏性的遗传性疾病,由ADA酶缺乏引起,如果不治疗将会致命。Revcovi的获批为这些患者带来了新的治疗选择,也体现出美国等发达国家对于罕见病用药开发的重视。

Revcovi是一种聚乙二醇化的重组腺苷脱氨酶(rADA)制剂,开发用于ADA-SCID的治疗。作为一种基因工程重组药物,Revcovi消除了从动物中提取酶的需求,该药上市后将成为Leadiant公司目前酶替代疗法(ERT)Adagen(pegademasebovine牛培格脱氨酶)的替代选择。
Revcovi的获批,是基于2项多中心、开放标签临床研究的结果。这些研究表明,Revcovi在ADA-SCID患者中增加了ADA活性,降低了ADA-SCID标志性的毒性代谢物浓度,并提高了淋巴细胞总数。
五、第4款PARP抑制剂,辉瑞抗癌新药:Talzenna
2018年10月16日,美国FDA宣布批准辉瑞(Pfizer)公司的抗癌新药Talzenna(talazoparib)上市,用以治疗携带生殖系BRCA突变(有害或怀疑有害),HER2阴性的局部晚期或转移性乳腺癌患者。用药方面,Talzenna的推荐剂量为每日口服一次1mg,与食物或不与食物同服。之前,FDA已授予Talzenna优先审查资格。

Talazoparib是辉瑞公司研发的创新PARP抑制剂。临床前研究表明talazoparib效力强劲,而且有双重作用机制,它能够通过阻断PARP酶的活性和将PARP酶束缚在DNA损伤位点的方式激发肿瘤细胞的死亡。Talazoparib的新药申请获得了美国FDA颁发的优先审评资格。此次批准,使Talzenna成为美国FDA批准的第4款PARP抑制剂,该药上市后将与阿斯利康的Lynparza、Clovis公司的Rubraca、Tesaro公司的Zejula展开竞争,预计未来五年销售额峰值能达到2.3亿美元。
六、抗流感神药:XOFLUZA
2018年10月24日,美国FDA宣布批准由日本盐野义制药公司(Shionogi)和罗氏(Roche)联合研发的抗流感新药Xofluza(baloxavir marboxil)上市,用于治疗12岁以上无并发症的急性流感患者。这是近20年以来,FDA批准的第一款具有创新作用机制的抗流感新药。

Xofluza是一款创新的Cap依赖型核酸内切酶抑制剂,也是世上少数可以抑制流感病毒增殖的新药。它能针对流感病毒复制的关键环节,抑制它从宿主细胞中获得宿主mRNA 5‘端的CAP结构,从而抑制流感病毒自身mRNA的转录。由于宿主细胞内不存在有类似机制的蛋白酶,这一药物理论上不会对宿主细胞产生影响。
Xofluza治疗流感有着诸多优势,首先它只需服用一次就可以见效,与奥司他韦胶囊在成人和13岁以上青少年的推荐口服剂量(每次75mg,每日2次,共5天)相比,可谓是一片顶过去十片。它也能够治疗对奥司他韦产生抗性的病毒株和禽流感病毒株(H7N9,H5N1),无论是适用范围和疗效均优于奥司他韦。2009年H1N1病毒流行,罗氏的奥司他韦销售额达32亿美元,Xofluza具有更快的抗病毒疗效,服药方案简单,不良反应更少,因此Xofluza非常有望达到奥司他韦的销售额高度。
结语创新驱动进步,新药的获批意味着患者有更多的治疗选择。自从2015年药审制度改革之后,新政的不断落地实施,国外新药进入国内的速度不断加快。国内企业也越发重视新药的开发,已经陆续有重磅新药问世。相信随着时间的推移,国内的患者将能和美国、欧盟等地区的患者一样同步享受到新药带来的福利。
来源:米内网全球药物研发数据库、FDA
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..