作者:强森
一个能够获批上市的药物分子,他的脚下往往铺垫着成千上万的分子基石,故每个成药分子都有他背后可圈可点且值得学习的故事。今天,在我们绞尽脑汁探索“A口袋” 、“B口袋”、“疏水作用”、“亲水作用”的同时,总是会有一些化学结构“出人意料”的药物分子脱颖而出,并成功上市,其成绩着实让人羡慕,其结构也着实让人感叹。笔者通过查询近20年上市药物的分子结构,总结了42个化学结构“很有意思”的药物分子,附之结构、药物简介、以及部分合成信息,望各位同仁茶余饭后之际,进一步开拓药物开发设计的思路。虽研发方向不同、靶点不同、设计思路不同,但毕竟这些分子都成药了,还是很值得推敲借鉴的。以下总结的这42个药物,将按照上市时间进行排列,细述。
1. NalbuphineSebacate(那布扶林)

入选理由:1)结构对称;2)“老结构”再用。
药物简介:那布扶林,由LumosaTherapeutics 研发,2017年年3月获台湾卫生福利部食品药物管理局批准上市,商品名为Naldebain®;那布扶林为μ-受体拮抗剂,同时也是κ-受体激动剂,用于缓解术后中、重度急性疼痛;纳疼解®活性成分已取得台、美、欧、韩、日、中等世界先进国与主要市场的专利保护;纳疼解®是一种长效剂型,肌肉注射后缓慢释出主要成分那布扶林。
合成简介:

参考:J. Chromatogr. B , 2000, 746, 241-247;US6225321。
2. Lutetium(177Lu) oxodotreotide

入选理由:1)引入元素Lu-177;2)引入二硫键;3)多个手性中心;4)裸露氨基、羟基、羧基等。
药物简介:Lutetium(177Lu) oxodotreotide,由Advanced AcceleratorApplications研发,2017年9月26日获欧洲EMA批准上市,2018年1月26日获美国FDA批准上市,由Advanced Accelerator Applications在欧盟和美国上市销售,商品名为Lutathera®;Lutetium (177Lu)oxodotreotide是一种Lu-177标记的生长抑素类似物,可与生长抑素受体结合,尤其对生长抑素受体2(SSRT2)亲和力最高;Lutathera®获批用于治疗生长抑素受体阳性的胃肠胰腺神经内分泌肿瘤。Lutathera®为静脉注射剂,每瓶含有370MBq/mL(10 mCi/mL),推荐剂量为每8周注射7.4GBq (200 mCi),共4个周期;每次给药Lutathera®和短效奥曲肽后,4到24小时肌肉注射长效奥曲肽30 mg;在完成Lutathera®治疗后,每4周肌内注射长效奥曲肽30 mg,直至病情进展或治疗开始长达18个月。
3. Deutetrabenazine(氘代丁苯那嗪)

入选理由:1)引入稳定性同位素D。
药物简介:Deutetrabenazine,由梯瓦公司研发,2017年4月3日获美国FDA批准上市,商品名为Austedo®;Deutetrabenazine是一种囊泡单胺转运体2(VMAT2)抑制剂;该药批准用于治疗与亨廷顿舞蹈症相关的舞蹈病症状。Austedo® 为口服片剂,每片含6 mg、9 mg和12 mg的deutetrabenazine。起始剂量为6 mg,每日一次;隔周服药,每日6mg,最高推荐每日剂量为48 mg(24 mg,每日两次),该剂量是减少舞蹈病发作的最大耐受剂量。
合成信息:

参考:WO2015077520A1、WO2015077521A1、US2015152099A1。
4. MigalastatHydrochloride(米加司他盐酸盐)

入选理由:1)结构看似简单;2)合成着实有趣。
药物简介:Migalastathydrochloride,由Amicus研发,2016年5月26日获欧洲EMA批准上市,商品名为Galafold®;Migalastathydrochloride与不稳定的α-半乳糖苷酶(α-GalA)结合,以增加该酶的稳定性,从而使该酶被转运至细胞内并分解酰基鞘鞍醇三己糖(GL-3);该药被批准用于治疗16岁以上青少年及成人法布瑞氏症。Galafold®为口服胶囊,每片含123 mg migalastat;推荐剂量为每次123 mg,隔天服用一次,至少饭前2 h或饭后2 h服用。
合成信息:

参考:CarbohydrateResearch 1986, 155,119-129;Angew. Chem.1967, 79, 151-152;J. Chem. Soc.C 1968, 567-569。
5. PitolisantHydrochloride(替洛利生)

入选理由:1)结构简单。
药物简介:Pitolisanthydrochloride,由Bioprojet公司研发,2016年3月31日获欧洲EMA批准上市,商品名为Wakix®;Pitolisant hydrochloride是一种组胺H3受体拮抗剂/反向激动剂,批准用于治疗嗜睡症。Wakix®为口服片剂,有4.5 mg和18 mg两种规格;初始推荐剂量为每日9 mg(4.5 mg,2片),然后根据病人的病情及耐受程度制定最低有效的用药计划,但是最大剂量不能超过每日36 mg。
合成信息:

参考:Eur J PharmSci 2001, 13(3) 249-259;US2004220225A1。
6. Galliumdotatate Ga-68

入选理由:1)分子中含Ga-68,同Lutetium(177Lu) oxodotreotide 类似。
药物简介:Galliumdotatate ga-68 ,由美国Advanced Accelerator Applications(AAA)公司研发,2016年6月1日获美国FDA批准上市,由AAA在美国上市销售,商品名为 Netspot®;Gallium dotatate ga-68与生长抑素受体结合,对亚型2受体(sstr2)有最高亲和力;它与表达生长抑素受体细胞结合,其中包括恶性细胞(过表达sstr2受体);Gallium dotatate ga-68是一种放射性诊断剂,用于通过正电子发射断层扫描(PET)来定位患有生长抑素受体阳性神经内分泌肿瘤(NETs)的成年和儿童患者的肿瘤定位。在成年和儿童患者,对于PET成像,Netspot®将被给予的推荐放射性量是2 MBq/kg体重(0.054 mCi/kg)至200 MBq(5.4 mCi)。
7. FluciclovineF 18

入选理由:1)结构简单;2)含放射性同位素F 18。
药物简介:Fluciclovine F 18,由Blue earth Diagnostics开发并在美国和欧洲上市销售,2016年5月27获美国FDA批准,2017年5月22日获欧洲EMA批准,商品名为Axumin®;
Fluciclovine F 18是通过氨基酸转运体如LAT-1和ASCT2在哺乳动物细胞膜中转运的合成氨基酸,其在前列腺癌细胞中上调;与周围的正常组织相比,前列腺癌细胞摄取的Fluciclovine F18更多;Axumin®是一种放射性诊断试剂,适用于以前接受过治疗的疑似前列腺癌复发的男性患者,基于其升高的血液前列腺特异性抗原(PSA)水平通过正电子发射断层扫描(PET)进行诊断。Axumin®是一种静脉注射液,每瓶30 ml,浓度为335-8200 MBq/mL (9-221 mCi/mL);推荐剂量为370 MBq (10mCi),给药方式为静脉注射。
合成信息:

参考:DOI: 10.1002/jlcr.1956
8. Tavaborole(他伐硼罗)

入选理由:1)结构简单。
药物简介:Tavaborole,由Anacor Pharmaceuticals公司研发,2014年7月7日获美国FDA批准上市,由Anacor Pharmaceuticals在美国上市销售,商品名为Kerydin®;
Tabavorole通过抑制氨酰转移核糖核酸(tRNA)合成酶(AARS),以抑制真菌蛋白合成,外用治疗由红色毛癣菌或须毛癣菌感染引起的灰指甲。Kerydin®为5%的外用溶液,含量为43.5 mg/mL tavaborole;推荐剂量为每日1次,持续48周。
合成信息:
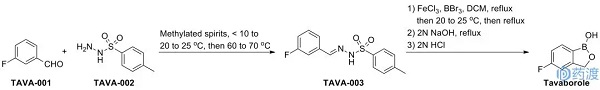
参考:WO9533754A1;Drugs. Fut.2006, 31, 667-669。
9. VorapaxarSulfate(硫酸沃拉帕沙)

入选理由:1)天然产物改造;2)手性中心大部分来源于合成,而非原料引入。
药物简介:硫酸沃拉帕沙,由先灵葆雅(Schering Plough)公司研发,后与默沙东公司联合研发,2014年5月8日由美国FDA批准上市,2015年1月19日获得欧洲EMA批准上市,由默沙东上市销售,商品名为Zontivity®;
硫酸沃拉帕沙是一种新型蛋白酶激活受体-1(PAR-1)拮抗剂,可抑制血小板聚集;该药用于减少有心梗(MI)或外周动脉病变(PAD)病史的患者发生心血管血栓事件的风险。Zontivity®是口服片剂,每片含2.08 mg 沃拉帕沙, 推荐剂量为:每日1次,每次1片。
合成信息:

参考:WO2006076415A2;WO2006076452A2;US2008004449A1。
10. DaclatasvirDihydrochloride(盐酸达拉他韦)

入选理由:1)结构对称。
药物简介:Daclatasvir Dihydrochloride,由百时美施贵宝(BMS)研发,2014年7月4日获日本PMDA批准上市,2014年8月22日获欧洲EMA批准上市,2015年7月24日获美国FDA批准上市,由百时美施贵宝上市销售,商品名Daklinza®;
DaclatasvirDihydrochloride是HCV NS5A复制复合体抑制剂,用于治疗丙型肝炎病毒感染。Daklinza®为口服片剂,每片含60 mgDaclatasvir;推荐剂量为每次60 mg,每日1次,与Asunaprevir联合用药,24周为1个疗程。
合成信息:

参考:WO2008021927A2;US8303944B2;US20100158862A1;WO2009020825A1;WO2009020828A1;CN102007122A。
11. OritavancinDiphosphate(奥利万星磷酸盐)

入选理由:1)结构复杂;2)含多个手性中心。
药物简介:奥利万星磷酸盐,由the Medicines Company研发,2014年8月6日获美国FDA批准上市,2015年3月19日获得欧洲EMA批准上市,由the Medicines Company上市销售,商品名为Orbactiv®;奥利万星磷酸盐是糖肽类抗生素,具有多重作用机制,如通过结合抑制细胞壁合成的肽而破坏细菌细胞膜的完整性,导致细胞死亡;适用于治疗由敏感革兰氏阳性菌导致的急性细菌性皮肤和皮肤结构感染。Orbactiv®为注射用冻干粉剂,每瓶含400 mg 奥利万星;推荐剂量为单次静脉注射1200 mg。
合成信息:

参考:WO9630401A1;J.Antibiot. 1996, 49, 575-581。
12. Topiroxostat(托匹司他)

入选理由:1)仅含3种元素组成;2)结构碱性强。
药物简介:托匹司他,由日本三和化学研究所(Sanwa Kagaku Kenkyusho)和日本富士药品(Fuji Yakuhin)联合研发, 2013年6月28日获日本PMDA批准上市,商品名为Uriadec®或Topiloric®;托匹司他是一种黄嘌呤氧化酶抑制剂,通过抑制黄嘌呤氧化酶,进而降低尿素在体内的产生;该药适用于痛风和高尿素血症的治疗。
Uriadec®/Topiloric®为口服片剂,每片含20、40、60 mg 托匹司他;推荐起始剂量为每次20mg,每日2次;维持剂量为每次60mg,每日2次;最大剂量为每次80 mg,每日2次。
合成信息:

参考:WO03064410A1;Bioorg. Med. Chem.Lett. 2009, 19, 6225-6229。
13. Glycerolphenylbutyrate(苯丁酸甘油酯)

入选理由:1)结构简单;2)仅含3种元素。
药物简介:苯丁酸甘油酯,由Hyperion Therapeutic研发,2013年2月1日获美国FDA批准上市,2015年11月27日获欧洲EMA批准上市,商品名为Ravicti®;苯丁酸甘油酯含有一种氮结合剂,通过去除蓄积在尿素循环代谢障碍患者的血液和大脑中的有毒氨而发挥作用,同时使患者体内氨的含量昼夜保持在安全水平;该药作为一种氮结合物,用于患有尿素循环障碍的不能单纯通过蛋白限制饮食或氨基酸补充剂控制的两岁以上儿童及成人患者的长期治疗。Ravicti®为口服液,含量为1.1 g/mL苯丁酸甘油酯;推荐剂量为每日4.5-11.2 mL/m2 (5-12.4 g/m2),随餐服用。
合成信息:

参考:EP2607366。
14. Flutemetamol(18F) (氟[18F]美他酚)

入选理由:1)含放射性同位素F 18。
药物简介:氟[18F]美他酚,由美国通用医疗(GE Healthcare)研发,2013年10月25日获美国FDA批准上市,2014年08月22日获欧洲EMA批准上市,2017年9月27日获日本PMDA批准上市,由美国通用医疗在美国和欧洲上市销售,由Nihon Medi-Physics在日本上市销售,商品名为Vizamyl®;氟[18F]美他酚是一种含有放射性氟-18的大脑正电子发射断层扫描(PET)成像用放射性诊断剂,用于阿尔茨海默病(AD)成人和其他认知下降患者β-淀粉样神经炎性斑块的显像。
合成信息:

参考:DOI: 10.1021/jacs.7b03131。
15. DimethylFumarate(富马酸二甲酯)

入选理由:1)分子量小;2)结构简单;3)仅含3种元素。
药物简介:富马酸二甲酯由百健研发,2013年3月27日获美国FDA批准上市,2014年1月30日获欧洲EMA批准上市,2016年12月19日获日本PMDA批准上市,由百健上市销售,商品名为Tecfidera®;富马酸二甲酯治疗多发性硬化症的作用机制尚未完全清楚;一般认为富马酸二甲酯(DMF)降解成其活性代谢产物富马酸单甲酯(MMF),MMF上调核因子Nrf2通路,Nrf2通路与氧化应激应答有关;该药用于复发型多发性硬化症患者的治疗。Tecfidera®为口服延迟胶囊,每粒含有120 mg或240 mg富马酸二甲酯;推荐起始剂量为每次120 mg,每日2次,持续7日,之后维持剂量为每日240mg,每日2次,随餐或空腹服用均可。
16.Florbetapir(18F)(氟贝他吡[18F])

入选理由:1)含放射性同位素F 18。
药物简介:氟贝他吡[18F],由美国礼来研发,2012年4月6日获美国FDA批准上市,2013年1月14日获欧洲EMA批准上市,2016年12月19日获日本PMDA批准上市,由礼来上市销售,商品名Amyvid®;氟贝他吡[18F]是一种放射性诊断试剂,可高度特异性地与大脑中的β-淀粉样蛋白结合,而后者是阿尔兹海默症的病理特征;氟贝他吡[18F]作为正电子发射断层摄影术(PET)的造影剂,用于阿尔茨海默病(AD)成人和其他认知下降患者β-淀粉样神经炎性斑块密度的估计。
合成信息:

参考:J. Label Compd. Radiopharm. 2013, 56 295-300。
17. RilpivirineHydrochloride(盐酸利匹韦林)

入选理由:1)游离碱仅含3种元素。
药物简介:盐酸利匹韦林,由强生公司研发,2011年5月20日获美国FDA批准上市,2011年11月28日获欧洲EMA批准上市,2012年5月18日获日本PMDA批准上市,并于2012年12月31日获中国CFDA批准上市,由强生在美国上市销售,商品名为Edurant®;盐酸利匹韦林是一种非核苷类逆转录酶抑制剂(NNRTI),联合其他抗逆转录病毒药物,用于治疗无HIV治疗史的成年患者的RNA小于或等于100,000 copies/ mL的HIV-1感染。Edurant®为口服片剂,每片含有25 mg利匹韦林;推荐剂量为单药治疗每次25mg,每日1次;与利福布汀(rifabutin)联合用药,每次50 mg,每日1次。
合成信息:

参考:WO03016306A1;Drugs. Fut. 2007, 32, 1046-1052;J. Med. Chem.2005, 48, 2072-2079。
18. RuxolitinibPhosphate(磷酸芦可替尼)

入选理由:1)游离碱仅含3种元素。
药物简介:磷酸芦可替尼,由Incyte和诺华联合开发,2011年11月16日获美国FDA批准上市,2012年8月23日获欧洲EMA批准,2014年7月4日获日本PMDA批准上市,由Incyte在美国上市销售,商品名为Jakafi®,由诺华在欧洲和日本上市销售,商品名为Jakavi®;芦可替尼为一种Janus激酶JAK1和JAK2的抑制剂,适用于中等或高危骨髓纤维化的治疗,包括原发性骨髓纤维化、真性红细胞增多症骨髓纤维化和原发性血小板增多症骨髓纤维化患者。Jakafi®为口服片剂,每片含有5 mg、10 mg、15 mg、20 mg或25 mg 芦可替尼,推荐剂量为对血小板计数大于200/μL患者,每次20 mg,每日2次;对血小板计数100/μL到200/μL之间患者,每次15 mg,每日2次。
合成信息:

参考:US2007135461A1;WO2010039939A1;WO2013023119A1。
19. Fampridine;Dalfampridine(达伐吡啶)

入选理由:1)结构超级简单;2)分子量<100;3)仅含3种元素。
药物简介:达伐吡啶,由AcordaTherapeutics研发,2010年1月22日获美国FDA批准,2011年7月20日获欧洲EMA批准,由Acorda Therapeutics在美国上市销售,商品名为Ampyra®;达伐吡啶是一种广谱钾通道阻滞剂,其作用机制尚未完全阐明,在动物研究实验中, 达伐吡啶被证明能够通过抑制钾离子通道而增加脱髓鞘轴突的动作电位的传导,改善患者的多发性硬化症(MS)的步行状态。Ampyra®为口服缓释片,每片含有10 mg达伐吡啶;推荐剂量为每次10 mg,每日2次(中间间隔12小时),随餐或空腹服用均可。
合成信息:

参考:US1879324A;US4140853A。
20. AmifampridinePhosphate(磷酸阿米吡啶)

入选理由:1)结构很简单;2)游离碱仅含3种元素。
药物简介:磷酸阿米吡啶,由BioMarin公司研发,2009年12月23日获欧洲EMA批准上市,由BioMarin公司在德国和英国市场销售,商品名为Firdapse®;阿米吡啶是一种钾离子通道阻断剂,通过阻断神经末梢钾离子通道来增加动作电位持续时间;该药用于治疗成人兰伯特-伊顿肌无力综合征。Firdapse®为口服片剂,每片含有10 mg阿米吡啶;推荐剂量为每次15 mg,每日1次,每4-5日可增加1次剂量,每次增加5 mg,最大剂量为每日60 mg。
合成信息:

参考:J.Heterocyclic Chem. 1986, 23, 669-671;US2004106651A1。
(注:大部分数据来源于药渡数据)
小结:
以上20个化学结构“有意思”的上市药物,上市年份区间为2017~2009;之所以感觉这些药物的结构有趣,理由主要为:有些结构过于复杂,看着虽头疼,但却着实可以一试;有些结构未免过于简单,复杂程度<日常使用的中间体,出乎意料;有些结构,元素组成简单,仅含C-H-O或者C-H-N,不需进一步修饰,即已成药;有些结构含特殊元素、同位素,如LU、Ga、D、F-18,等等等等......在《下篇》中,将继续介绍这些“有意思”的药物分子,其中不乏美金刚、丁苯酞、三氧化二砷等药物,敬请期待。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..